您当前的位置: 新闻中心
- 2023-06-21原产地认证:日本要求医疗器械进口商提供产品的原产地证明文件。这可以是由出口国家或地区的政府或认可机构颁发的相关证明。
- 2023-06-21医疗器械的原产地认证:日本要求医疗器械进口商提供产品的原产地证明文件,例如由出口国家或地区的政府或认可机构颁发的相关证明。
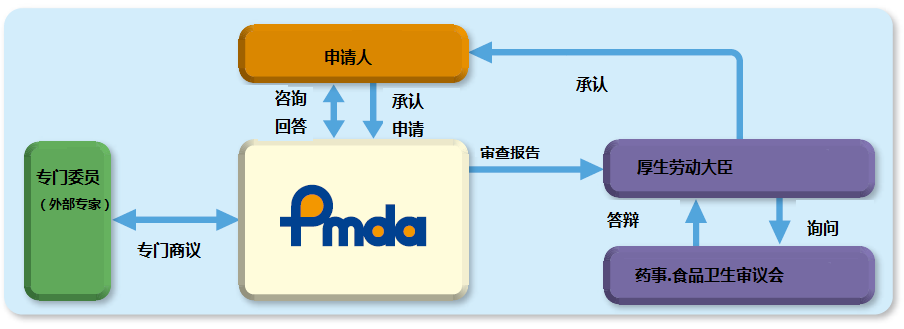
- 2023-06-21在日本,医疗器械的认证由日本药品医疗器械管理局(Pharmaceuticals and Medical Devices Agency,PMDA)负责。
- 2023-06-21根据欧盟体外诊断医疗器械法规(In Vitro Diagnostic Medical Devices Regulation,IVDR),医疗器械的分类是根据其风险水平进行确定的。
- 2023-06-21欧盟医疗器械CE-IVDR认证是指欧洲联盟(European Union,EU)对于体外诊断器械(In Vitro Diagnostic Medical Devices,IVD)的认证要求。
- 2023-06-21IVDR(In Vitro Diagnostic Medical Devices Regulation)是欧洲联盟针对体外诊断医疗器械制定的法规。
- 2023-06-21首先需要确定产品是否属于A类体外诊断医疗器械的范畴,根据IVDR的规定进行分类确认。
- 2023-06-21根据欧洲联盟的《IVDR(In Vitro Diagnostic Medical Devices Regulation)》,A类体外诊断医疗器械(In Vitro Diagnostic Medical Devices)需要进行CE认证。
- 2023-06-21ISO 13485体系认证要求医疗器械制造商和供应商满足一系列质量管理要求。
- 2023-06-21ISO 13485是医疗器械质量管理体系的国际标准,它规定了医疗器械制造商和供应商应满足的质量管理要求。
- 2023-06-21ISO 13485是国际标准化组织(ISO)制定的医疗器械质量管理体系标准。它规定了医疗器械制造商和供应商应遵循的质量管理体系要求,旨在确保医疗器械的质量、安全性和合规性。
- 2023-06-21确定您希望申请MDSAP认证的产品范围,包括涵盖的产品类别和适用的国家市场。

.jpg)

.jpg)
.jpg)



