很多IVD企业在开展临床试验研究时经常会碰到这样的问题:临床入组样本量应具有统计学参考意义,但在没有相关产品临床试验CS指南文件的情况下,不清楚应该怎么去确定产品需要入组多少样本量。
今天,IVDEAR团队为您分享一些比较常用且非常实用的临床样本量的确定方法。
一、常见的定性试剂的样本估算原理和公式
1. 《体外诊断试剂临床试验技术指导原则》介绍了基于统计学要求的最低样本量估计的相关公式。根据临床需要设定适当的临床可接受标准,也就是单组目标值法样本量估算法,是采用下面公式分别估算阳性和阴性样本。
.png)
n:样本量;
α:一类错误概率,一般设定为双侧0.05或单侧0.025;
β:二类错误概率,设定为不大于0.2,一般按0.2计算;
Z(1-α/2):显著性水平的标准正态分布的分数位,Z(0.975)=1.96;
Z(1-β):把握度的标准正态分布的分数位,Z(0.8)=0.84;
P0:评价指标的临床可接受标准;
PT:试验体外诊断试剂评价指标预期值;
(PT- P0):总体参数差异。
估算示例1:首先将提前公式输入,然后在E,H列分别输入灵敏度可接受标准85%和灵敏度预期值94%,可计算得出阳性样本至少需100例(有小数建议进一位取整,其他案例同理),考虑10%的脱落率计算后,可计算得出阳性样本至少需111例。
.png)
Fig. 1 估算示例1
同理,可在E,H列分别输入特异性可接受标准90%和特异性预期值95%,计算得出阴性样本至少需264例(如Fig1, 右)。
2. 根据需要,只保证评价指标满足期望精度水平(置信区间的宽度一定),而不设定临床可接受标准的情况,可采用如下公式:
.png)
公式中:
n:样本量;
Z(1-α/2):显著性水平的标准正态分布的分数位,一般设定为双侧0.05或单侧0.025;
Z(0.975)=1.96;
P为评价指标预期值,Δ为P的允许误差大小。
采用上述公式,可根据灵敏度或特异度的预期值分别估算具有目标疾病状态的受试者(阳性)或不具有目标疾病状态的受试者(阴性)的样本量。
估算示例2:按照示例1中方式一步一步提前输入公式即可。分别输入预期灵敏性85%和预期特异性95%,允许误差Δ设定为0.05,依次可计算得出阳性样本至少需218例,阴性性样本至少需82例(考虑10%脱落率)。
注:上述方程是基于二项分布的正态近似,当TPF或FPF接近1.0时,这个假设就失效了。
3. 另外,当灵敏度或特异度小于20%或大于80%时,样本率的分布呈偏态,需对符合率的平方根进行反正弦转换,样本量计算公式为:
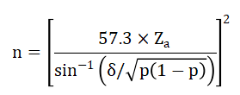
公式中:
n:样本量;
Zα:1.96;
σ:一般取0.08;
p:灵敏度或特异性的符合率。
估算示例3:假设预期灵敏度85%和预期特异性80%,允许误差Δ设定为0.05,依次可计算得出阳性样本至少需84例,阴性性样本至少需106例(考虑10%脱落率)。
二、定量检测的样本量估算
定量检测可根据相关系数估算样本量,公式计算,公式如下:
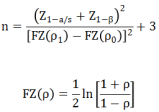
公式中:
n:样本量;
a:一类错误概率,设定为双侧0.05或单侧0.025;
β:二类错误概率,一般按0.2计算;
Z(1-α/s)和Z(1-β)表示对应于α和β的标准正态分布百分位数;
s这里指的是单侧或双侧检验,s=1为单侧,s=2为双侧;
p0为相关系数可接受标准值,p1为预期相关系数值。
估算示例4:根据CLSI EP9-A2文件的标准,对比试剂与候选试剂的直线相关系数不得低于0.975(p0),那我们假设线性系数为0.985(p1)设定单侧参数:S=1, a=0.025,β=0.2,根据上面的公式我们可以计算出,样本量n为121例。如果考虑10%的脱落剔除率,那么最低样本量为121/0.9=135例。
三、计算样本量软件
除了上述样本量计算公式外,也可以直接借助软件来计算,今天小编将重点介绍如下两种软件。
1、利用PASS软件估算样本量的方法
(1) PASS
PASS(Power Analysis and Sample Size)美国NCSS公司开发,能对数十种统计学检验条件下的检验效能和样本含量进行估计。
(2) PASS操作
估算原理:采用单组目标值类似原理。在左侧界面中依次选择“Procedures—“Sensitivity and Specificity—“Test for One-Sample Sensitivity and Specificity”,然后在面板设置好各个参数,分别进行灵敏度和特异性的样本计算,最后软件计算出不同疾病流行率下所需的最少样本数量,如 Fig.2所示。
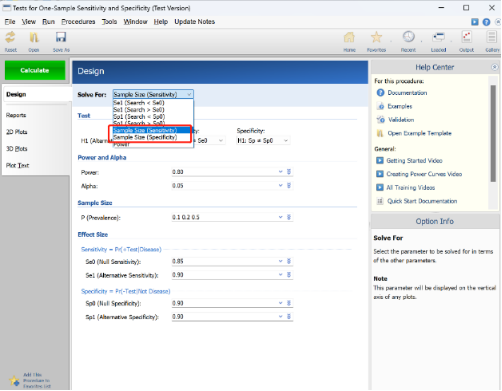
Fig.2 设置参数界面
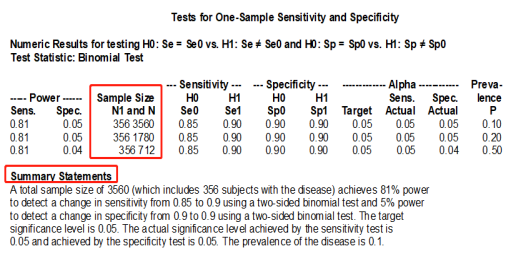
Fig.2 参数界面和结果
结果解释:分别进行阳性、阴性样本量估算,每次估算可得到不同疾病流行率下,诊断灵敏度或诊断特异性所需的阳性和阴性样本估算结果,最终阳性和阴性样本量取两次估算值的较大值。
2、IVD statistics
可以分别计算定性、定量产品的样本量,另外还可以进行灵敏度、特异性,置信区间、KAPPA,ROC等分析。如Fig.3,根据既定的相关参数进行设置后计算出结果。
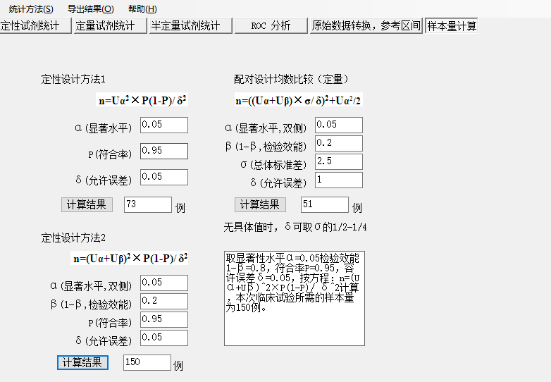
Fig.3 IVD statistics样本量计算
根据既定的相关参数进行设置后计算出结果。
3、讨论
本文中介绍了定性样本量计算公式,原理是基于可接受标准,指定置信区间宽度进行计算。另外,当灵敏度或特异度小于20%或大于80%时,样本率的分布呈偏态的定性产品的样本量如何计算,以及对于定量产品,可以采用相关系数检验的公式来估算样本量。
除此之外,本文还展现了PASS和IVD statistics软件。PASS软件需考虑疾病流行率来计算样本量大小。但是由于流行率的参数来源于相关文献记录或者疾病控制中心的实时监控和统计,考虑疾病的流行率后,那代表同一个疾病在不同流行期、不同地域都会有变化,实际执行较为困难。
当然,需要注意的是,以上样本量估算方法仅是一些比较常用及实用的方法。而具体到临床试验方案的总体设计上,还需要临床技术专家根据具体的临床试验项目且结合法规、竞品、经验等多方面因素综合考量和打磨而最终敲定。
四、IVD产品注册、临床试验研究
聊到这里,小编想说:IVDEAR团队可以帮助您精心设计试验方案和高效完成临床试验研究报告,协助您快速取证。
目前我们可承接开展以下体外诊断试剂产品的注册及临床试验研究:如肿瘤标志物检测试剂、糖尿病相关检测试剂、激素指标检测试剂、心肌标志物检测试剂、炎症指标检测试剂、呼吸道病原体检测试剂、传染病检测试剂、血型检测试剂、甲基化检测产品等产品的临床试验研究,覆盖了大部分的IVD产品类别。
有相关项目需求的企业请联络IVDEAR团队。


