艾滋病仍然是全球主要的公共卫生问题。根据联合国艾滋病规划署数据显示,2018年世界人口中估计有3790万人感染艾滋病毒,其中还包括170万名儿童,携带者数量仍逐年增长。
全球HIV自我检测市场的发展,得益于艾滋病毒在全球范围内的流行程度不断上升,民众对先进检测技术和诊断方法的需求剧增,为HIV自测产品的应用带来大量的市场需求,预计全球HIV自我检测市场将迅速增长。
2018年全球艾滋病毒自我检测市场达到4436万美元,预计到2025年年底将达到10.41亿美元,2020年至2025年期间全球的CAGR将达到45.62%。此外,到2025年,全球艾滋病自我检测市场的增长率预计将达到40.77%。
全球艾滋病病毒样本检测方式有三种,分别为血液、唾液和尿液检测,其中主要以血液样本检测为主。
目前,全球范围内HIV自我诊断测试主要企业,包括:
· Autotest VIH
· BioLytical Laboratories
· BioSure UK
· OraSure Technologies, Inc.
· Atomo Diagnostics
· Biosynex
· NEXUS Laboratories
· Nectar Lifesciences Limited
2018年血液检测占据的市场份额为47.12%,占据了全球最大的艾滋病病毒自检市场。预计到2025年底,血液板块将超过4.801亿美元,并以45.18%的复合年增长率蓬勃发展。
HIV自测产品如何进入欧洲市场?
今天我们重点讲解的是关注度较高的HIV自测产品欧洲市场准入的临床试验要求情况,HIV在欧洲开展临床试验研究需遵守哪些法规要求?IVDR法规、ISO20916、欧盟成员国临床GCP法规、欧盟CS指南。
HIV在IVDR法规下的产品划分在CLASS D类别;
HIV自测检测试剂需要符合IVDR要求的临床样本量(参考CS指南文件ANNEX III中的Table 2和Table 6):
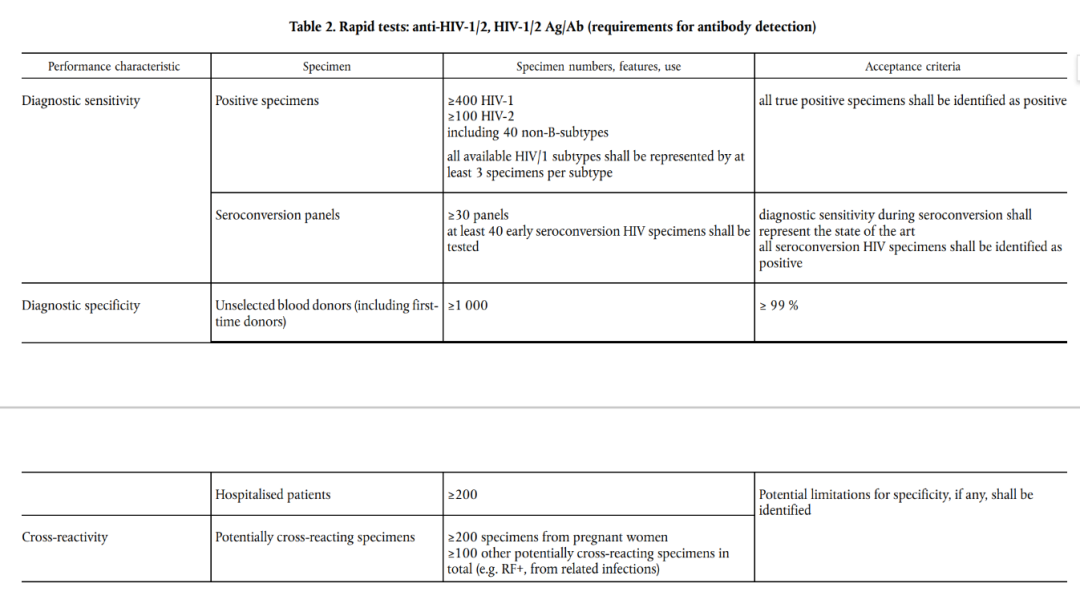
按照欧盟CS指南中的要求,在欧洲开展HIV检测试剂的临床试验研究存在以下难点:
1. 在阳性病例的要求中,需入组至少100例 HIV-2型样本,而HIV-2亚型在欧洲并不流行,其样本收集难度极大;
2. 阴性样本入组的要求中,至少需入组1000例来自献血中心的样本,且献血中心不低于2个采样点;
3. 至少需入组200例孕妇样本,而在欧洲开展临床试验研究收集孕妇的样本其实是有一定的难度的;
4. 至少需入组100例交叉反应样本。
需要注意的是,HIV自我检测产品。除了需开展临床试验研究外,还需要进行Lay persons可用性研究,参照CS文件中ANNEX III Table 6的要求:
我们可以看出,进行Lay persons可用性试验的难度也是比较大的,须满足以下条件:
1. 需入组已知阳性病例至少200例以上;
2. 需入组高风险人群的受试者至少200例以上。
可用性研究试验的样本收集均需按照新鲜样本的方式进行采集和测试,其中比较难以收集的样本主要为高风险人群,对于高风险的人群一般为:性工作者、同性恋者、共用注射器者、有危险的性行为者等人群,由于这类人群涉及的隐私性较高,在受试者招募时将会带来一定的难度。
总之,HIV自测市场已有部分IVD企业在准备开展临床研究及注册等市场布局,可以明确的是,目前在HIV自测国际市场领域,还未有跻身国际一线品牌的中国企业出现,绝大多数中国企业均在同一起跑线上!
不过,以欧盟CE IVDR为例,该领域的临床试验难度较高,成本投入较大,IVDEAR团队建议企业应审慎评估。
后疫情时代,新冠给IVD企业带来的红利也随之退却,未来IVD行业有两种企业会走的更长远,一种是具备“大而全”综合竞争实力的IVD头部企业、另一种是在细分领域专精沉淀并做出优势的IVD企业。而对于大多数的中小型企业而言,面临被洗牌与整合将是大势所趋了!
开展HIV自测产品欧洲临床试验
IVDEAR团队具备多临床中心同时开展HIV自测产品临床试验及可用性研究的条件,已制定HIV自测产品完备的临床试验方案,对临床试验中的样本例数、入组标准、排除标准、剔除标准、不一致分析方式、对比方法等重点内容均做出合理设计。临床试验研究地点主要以具备传染病诊断和治疗的公立医院为主,在受试者的招募时具备一定的优势!
.jpg)
我们还可承接开展以下体外诊断试剂产品的注册及临床试验研究:如肿瘤标志物检测试剂、糖尿病相关检测试剂、激素指标检测试剂、心肌标志物检测试剂、炎症指标检测试剂、呼吸道病原体检测试剂、传染病检测试剂、血型检测试剂、甲基化检测产品等产品的临床试验研究,覆盖了大部分的IVD产品。
有相关项目需求的企业请联络IVDEAR团队,详情咨询15816864648。


